A compreensão do que compõe a matéria não surgiu da noite para o dia. Foi uma construção de séculos, onde cada cientista “subiu nos ombros de gigantes” para refinar nossa visão sobre a unidade básica do universo.
Dessa forma, entender os modelos atômicos é compreender como a própria ciência evolui através da observação e do método experimental.
O que são modelos atômicos?
Modelos atômicos são representações teóricas criadas por cientistas para explicar a estrutura e o comportamento dos átomos.
Como os átomos são pequenos demais para serem vistos diretamente, esses modelos funcionam como “mapas” que evoluem conforme novas descobertas surgem.
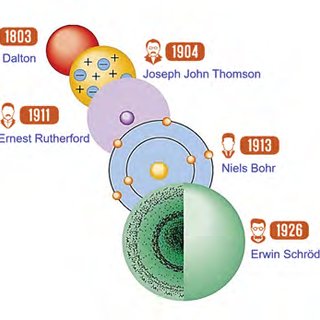
1. Modelo de Dalton (1803): A bola de bilhar
John Dalton foi o responsável por retomar as ideias dos filósofos gregos Leucipo e Demócrito, mas sob uma ótica científica. Para ele, o átomo era:
-
Maciço e indivisível;
-
Indestrutível;
-
Esférico.
Dalton acreditava que elementos diferentes eram feitos de átomos com massas diferentes, mas que, dentro de um mesmo elemento, todos os átomos eram idênticos.
2. Modelo de Thomson (1898): O famoso pudim de passas
Com a descoberta do elétron (partícula de carga negativa), o modelo de Dalton “quebrou”. Joseph John Thomson propôs que o átomo não era indivisível.
-
O átomo seria uma “gelatina” de carga positiva;
-
Os elétrons estariam incrustados nessa massa, como passas em um pudim.
-
Contribuição: O átomo passa a ter uma natureza elétrica neutra (equilíbrio entre cargas positivas e negativas).
3. Modelo de Rutherford (1911): o modelo planetário
Ernest Rutherford realizou o famoso experimento com a folha de ouro e percebeu que a maioria das partículas atravessava a matéria.
Sua conclusão mudou tudo: o átomo é, em sua maior parte, um vazio.
-
Núcleo: Pequeno, denso e positivo.
-
Eletrosfera: Uma região vasta onde os elétrons giram ao redor do núcleo, como planetas ao redor do Sol.
4. Modelo de Bohr (1913): os níveis de energia
Niels Bohr refinou o modelo de Rutherford para explicar por que os elétrons não “caíam” no núcleo. Ele introduziu a ideia de que:
-
Os elétrons orbitam em camadas com energias fixas;
-
Ao ganhar energia, o elétron pula para uma camada externa (salto quântico);
-
Ao retornar, ele libera essa energia na forma de luz (fóton).
Quais são as diferenças entre os modelos atômicos?
| Cientista | Ano | Analogia | Principal Característica |
| Dalton | 1803 | Bola de Bilhar | Átomo maciço e indivisível. |
| Thomson | 1898 | Pudim de Passas | Descoberta do elétron e divisibilidade. |
| Rutherford | 1911 | Sistema Solar | Existência de núcleo e eletrosfera. |
| Bohr | 1913 | Orbitais de Energia | Elétrons em camadas circulares fixas. |
O modelo atual (mecânica quântica)
Hoje, com as contribuições de Schrödinger e Heisenberg, sabemos que não podemos prever a posição exata de um elétron, mas sim a probabilidade de encontrá-lo em uma região chamada orbital.
O átomo moderno é visto como uma “nuvem eletrônica”.
Referências Bibliográficas:
-
ATKINS, P.; JONES, L. Princípios de Química: Questionando a vida moderna e o meio ambiente. Porto Alegre: Bookman, 2012.
-
RUSSELL, J. B. Química Geral. São Paulo: Makron Books, 1994.
Publicar comentário